Природные источники радона. Радон и методы оценки радоновой опасности
В среднем примерно 2/3 эффективной эквивалентной дозы облучения, которую человек получает от естественных источников радиации, поступает от радиоактивных веществ (калий-40, свинец-210, полоний-210 и пр.), попавших в организм с пищей, водой и воздухом.
Источники ионизирующего излучения, созданные человеком:
- источники, использующиеся в медицине.
Средняя индивидуальная доза за счет этого источника во всем мире составляет ~ 400 мкЗв на человека в год. Таким образом, коллективная эффективная эквивалентная доза для всего населения равна примерно 1600000 чел-Зв в год.
- ядерные испытания.
Наиболее опасны воздушные взрывы. Часть радиоактивного материала выпадает неподалеку от места испытания, какая-то часть задерживается тропосфере (самом нижнем слое атмосферы), подхватывается ветром и перемещается на большие расстояния, оставаясь примерно на одной и той же широте. Находясь в воздухе в среднем около месяца, радиоактивные вещества во время этих перемещений постепенно выпадают на землю. Однако большая часть радиоактивного материала выбрасывается в стратосферу – следующий слой атмосферы, лежащий на высоте 10-50 км, где он остается многие месяцы, медленно опускаясь и рассеиваясь по всей поверхности земного шара.
Вносят весьма незначительный вклад в суммарное облучение населения АЭС. При нормальной работе ядерных установок выбросы радиоактивных материалов очень невелики.
Радон – элемент главной подгруппы восьмой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 86. Обозначается символом Rn (Radon). Простое вещество радон в нормальных условиях – бесцветный инертный газ; радиоактивен, может представлять опасность для здоровья и жизни. При комнатной температуре является одним из самых тяжелых газов. Наиболее стабильный изотоп (222Rn) имеет период полураспада 3,8 суток.
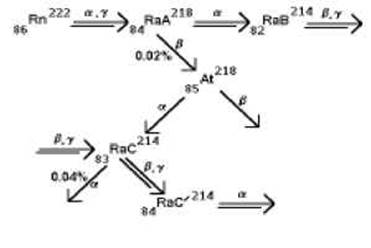
Схема распада радона
Входит в состав радиоактивных рядов 238U 235U и 232Th. Ядра радона постоянно возникают в природе при радиоактивном распаде материнских ядер. Равновесное содержание в земной коре 7х10-16 % по массе. Ввиду химической инертности радон относительно легко покидает кристаллическую решётку «родительского» минерала и попадает в подземные воды, природные газы и воздух. Поскольку наиболее долгоживущим из четырех природных изотопов радона является 222Rn, именно его содержание в этих средах максимально.
Концентрация радона в воздухе зависит в первую очередь от геологической обстановки (так, граниты, в которых много урана, являются активными источниками радона; в то же время над поверхностью морей радона мало), а также от погоды (во время дождя микротрещины, по которым радон поступает из почвы, заполняются водой; снежный покров также препятствует доступу радона в воздух). Перед землетрясениями наблюдалось повышение концентрации радона в воздухе, вероятно, благодаря более активному обмену воздуха в грунте ввиду роста микросейсмической активности.
Для получения радона через водный раствор любой соли радия продувают воздух, который уносит с собой образующийся при радиоактивном распаде радия радон. Далее воздух тщательно фильтруют для отделения микрокапель раствора, содержащего соль радия, которые могут быть захвачены током воздуха. Для получения собственно радона из смеси газов удаляют химически активные вещества (кислород, водород, водяные пары и т. д.), остаток конденсируют жидким азотом, затем из конденсата отгоняют азот и другие инертные газы (аргон, неон и т.д.).
Радон – радиоактивный одноатомный газ без цвета и запаха. Растворимость в воде 460 мл/л; в органических растворителях, в жировой ткани человека растворимость радона в десятки раз выше, чем в воде. Газ хорошо просачивается сквозь полимерные плёнки. Легко адсорбируется активированным углем и силикогелем.
Собственная радиоактивность радона вызывает его флюоресценцию. Газообразный и жидкий радон флюоресцирует голубым светом, у твёрдого радона при охлаждении до азотных температур цвет флюоресценции становится сперва жёлтым, затем красно-оранжевым.
«Благородный газ». Радон образует клатраты, которые, хотя и имеют постоянный состав, химических связей с участием атомов радона в них нет. С фтором радон при высоких температурах образует соединения состава RnFn, где n = 2, 4, 6. Так, дифторид радона RnF2 является белым нелетучим кристаллическим веществом. Фториды радона могут быть получены также под действием фторирующих агентов (например, фторидов галогенов). При гидролизе тетрафторида RnF4 и гексафторида RnF6 образуется оксид радона Кп03. Получены также соединения с катионом RnF+.
Тонкости педагогики:
Содержание начального образования непрерывного курса информатики
В обучении информатике принято выделять четыре ступени: пропедевтическую (начальный курс), базовую (базовый курс), профильную (профильные курсы), профессиональную (вузовский курс). Основная задача начальной школы — дать основы для получения образования (в общем смысле — научить читать, писать, счит ...
Описание выборки и методик обследования
Диагностическая работа является важным направлением педагогического сопровождения опекунских семей, принявших на воспитание детей, оставшихся без попечения родителей. Цель диагностики – информационное обеспечение процесса сопровождения опекунских семей с целью выбора средств, методов и форм оказани ...
Общественно-политическое воспитание учащихся: трудности и нерешенные проблемы
В изучаемый период в условиях тоталитаризма, диктата КПСС, командно-бюрократической системы, когда такие явления, как социальное лицемерие, разрыв слова и дела, игнорирование интересов личности, прочно утвердились в социально-политической жизни советского общества, воспитательный процесс подвергалс ...
Разделы сайта
- Главная
- Семейная педагогика
- История развития образования
- Развитие и сущность педагогики
- Управление качеством образования
- Семья и дошкольные учреждения
- Личностно-ориентированное обучение
- Современная педагогика
